Содержание
- 1 Регистрация и сертификация изделий медицинского назначения
- 2 Регистрация изделий медицинского назначения
- 3 Регистрация медицинских изделий
- 4 Экспертный центр «РегистрПро»
- 5 Государственная регистрация медицинских изделий отечественного и зарубежного производства в ФС Росздравнадзор
- 6 Регистрация медицинских изделий
- 7 Сертификация изделий медицинского назначения и медицинской техники
- 8 Сертификация программ медицинского назначения
Регистрация и сертификация изделий медицинского назначения
Заявление о государственной регистрации содержит:
а) наименование медицинского изделия (с указанием принадлежностей, необходимых для применения медицинского изделия по назначению), при этом заявитель указывает товарный знак и иные средства индивидуализации медицинского изделия в случае их нанесения на упаковку медицинского изделия;
б) в отношении разработчика — полное и (в случае, если имеется) сокращенное наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес места его нахождения или фамилия, имя и (в случае, если имеется) отчество, реквизиты документа, удостоверяющего личность, адрес места жительства индивидуального предпринимателя, а также номера телефонов и (в случае, если имеется) адрес электронной почты юридического лица или индивидуального предпринимателя;
в) в отношении производителя (изготовителя) медицинского изделия — полное и (в случае, если имеется) сокращенное наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес места нахождения или фамилия, имя и (в случае, если имеется) отчество, реквизиты документа, удостоверяющего личность, адрес места жительства индивидуального предпринимателя, а также номера телефонов и (в случае, если имеется) адрес электронной почты юридического лица или индивидуального предпринимателя;
г) в отношении уполномоченного представителя производителя (изготовителя) — полное и (в случае, если имеется) сокращенное наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес места его нахождения или фамилия, имя и (в случае, если имеется) отчество, реквизиты документа, удостоверяющего личность, адрес места жительства индивидуального предпринимателя, а также номера телефонов и (в случае, если имеется) адрес электронной почты юридического лица или индивидуального предпринимателя;
д) в отношении лица, на имя которого может быть выдано регистрационное удостоверение, — полное и (в случае, если имеется) сокращенное наименование, в том числе фирменное наименование, организационно-правовая форма юридического лица, адрес места его нахождения или фамилия, имя и (в случае, если имеется) отчество, реквизиты документа, удостоверяющего личность, адрес места жительства индивидуального предпринимателя, а также номера телефонов и (в случае, если имеется) адрес электронной почты юридического лица или индивидуального предпринимателя;
е) место производства медицинского изделия;
ж) назначение медицинского изделия, установленное производителем (изготовителем);
з) вид медицинского изделия в соответствии с номенклатурной классификацией медицинских изделий;
и) класс потенциального риска применения медицинского изделия в соответствии с номенклатурной классификацией медицинских изделий;
к) код Общероссийского классификатора продукции по видам экономической деятельности;
л) сведения о способе получения регистрационного удостоверения, а также информации, связанной с процедурой государственной регистрации медицинского изделия.
Комплект документов для государственной регистрации состоит из:
а) копия документа, подтверждающего полномочия уполномоченного представителя производителя (изготовителя);
б) сведения о нормативной документации на медицинское изделие;
в) техническая документация производителя (изготовителя) на медицинское изделие;
г) эксплуатационная документация производителя (изготовителя) на медицинское изделие, в том числе инструкция по применению или руководство по эксплуатации медицинского изделия;
д) фотографические изображения общего вида медицинского изделия вместе с принадлежностями, необходимыми для применения медицинского изделия по назначению (размером не менее 18 x 24 сантиметра);
е) документы, подтверждающие результаты технических испытаний медицинского изделия;
ж) документы, подтверждающие результаты токсикологических исследований медицинского изделия, использование которого предполагает наличие контакта с организмом человека;
з) документы, подтверждающие результаты испытаний медицинского изделия в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается Министерством здравоохранения Российской Федерации);
и) опись документов;
к) для медицинских изделий 1 класса потенциального риска применения и медицинских изделий для диагностики in vitro — сведения, подтверждающие клиническую эффективность и безопасность медицинских изделий;
КОНСУЛЬТАЦИЯ ЮРИСТА
8 800 350 84 37
л) проект плана клинических испытаний медицинского изделия с обосновывающими его материалами (в случае, если имеется);
м) сведения о выданных регистрирующим органом разрешениях на ввоз медицинских изделий с целью их государственной регистрации (для медицинских изделий иностранного производства);
н) копии документов, подтверждающих качество лекарственного препарата, фармацевтической субстанции, биологического материала и иного вещества, с использованием которых произведено медицинское изделие или которые входят в его состав и которые предназначены для применения только с учетом назначения медицинского изделия, определенного производителем, и выданных в соответствии с законодательством страны происхождения лекарственного препарата, фармацевтической субстанции, биологического материала и иного вещества.
Сроки и последовательность административных процедур и административных действий Росздравнадзора установлены Административным регламентом Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по государственной регистрации медицинских изделий», утвержденным приказом Федеральной службы по надзору в сфере здравоохранения от 06.05.2019 № 3371.
Государственная регистрация медицинских изделий осуществляется Росздравнадзором в срок, не превышающий 50 рабочих дней со дня принятия решения о начале государственной регистрации медицинских изделий.
Срок проведения клинических испытаний медицинского изделия в 50-дневный срок не включается.
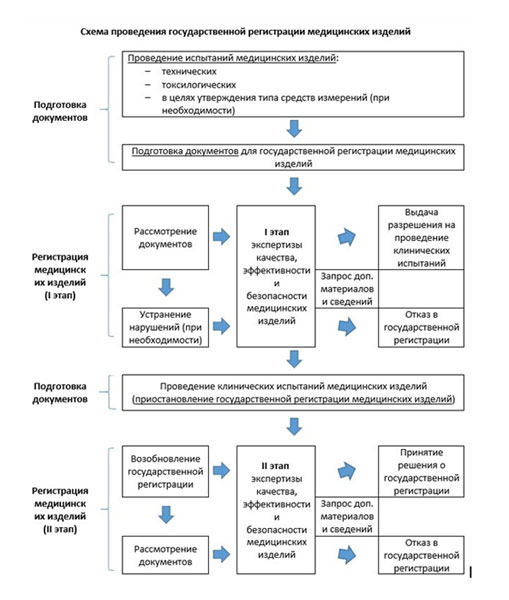
Экспертиза качества, эффективности и безопасности медицинского изделия проводится экспертным учреждением поэтапно (предусмотрено 2 этапа) в соответствии с порядком, утверждаемым Министерством здравоохранения Российской Федерации:
а) на I этапе осуществляется экспертиза заявления о регистрации и документов, указанных в пункте 10 Правил, для определения возможности (невозможности) проведения клинических испытаний медицинского изделия;
б) на II этапе осуществляется экспертиза полноты и результатов проведенных технических испытаний, токсикологических исследований, клинических испытаний, а также испытаний в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается Министерством здравоохранения Российской Федерации) (далее — экспертиза полноты и результатов испытаний и исследований).
В настоящее время появилась возможность в рамках экспертизы качества, эффективности и безопасности медицинских изделий для целей государственной регистрации на любом этапе экспертизы запрашивать у заявителей недостающие материалы и сведения (в том числе возможность устранить замечания и недостатки, выявленные в ходе экспертизы).
После первого этапа экспертизы определяется возможность/невозможность проведения клинических испытаний медицинского изделия или возможность/невозможность государственной регистрации медицинского изделия (для медицинских изделий 1 класса потенциального риска применения и медицинских изделий для диагностики in vitro).
Клинические испытания медицинского изделия проводятся на основании разрешения на проведение клинических испытаний, выданного Росздравнадзором.
Клинические испытания медицинского изделия проводятся в медицинских организациях включенных в Перечень медицинских организаций, проводящих клинические испытания медицинских изделий, ведение которого также осуществляет Росздравнадзор.
По окончании клинических испытаний медицинского изделия заявитель представляет в Росздравнадзор заявление о возобновлении государственной регистрации медицинского изделия и результаты клинических испытаний медицинского изделия,
На II этапе экспертизы качества, эффективности и безопасности медицинского изделия экспертная организация проводит экспертизу полноты и результатов проведенных испытаний и исследований, а также оформляет и направляет в регистрирующий орган заключение по результатам экспертизы качества, эффективности и безопасности медицинского изделия.
Основанием для принятия решения об отказе в государственной регистрации медицинского изделия является получение регистрирующим органом от экспертного учреждения заключения по результатам экспертизы качества, эффективности и безопасности медицинского изделия, свидетельствующего о том, что качество и (или) эффективность и (или) безопасность регистрируемого медицинского изделия не подтверждены полученными данными, и (или) о том, что риск причинения вреда здоровью граждан и медицинских работников вследствие применения медицинского изделия превышает эффективность его применения.
В течение 1 рабочего дня после принятия решения о государственной регистрации медицинского изделия Росздравнадзор вносит данные о зарегистрированном медицинском изделии в Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий.
В соответствии с Налоговым кодексом Российской Федерации государственная пошлина за проведение экспертизы качества, эффективности и безопасности медицинских изделий составляет:
класс 1 — 45 000 рублей;
класс 2а — 65 000 рублей;
класс 2б — 85 000 рублей;
класс 3 — 115 000 рублей.
За государственную регистрацию медицинского изделия предусмотрена пошлина в размере 7 000 рублей.
Регистрация изделий медицинского назначения
Приборы, аппараты, инструменты, комплекты, наборы реагентов и пр.
«Медицинскими изделиями являются любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека. Медицинские изделия могут признаваться взаимозаменяемыми, если они сравнимы по функциональному назначению, качественным и техническим характеристикам и способны заменить друг друга».
Медицинские изделия (ИМ) подразделяются на классы в зависимости от потенциального риска их применения и на виды в соответствии с номенклатурной классификацией ИМ, классификации регламентируются Приказом Министерства Здравоохранения Российской Федерации от 16 июня 2012 г., № 4н «Об утверждении номенклатурной классификации медицинских изделий».
Необходимым условием для обращения ИМ на территории РФ является его государственная регистрация (323-ФЗ). Функция по осуществлению регистрации ИМ, согласно Приказу Министерства Здравоохранения Российской Федерации от 14 октября 2013 г., N 737 н «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения по предоставлению государственной услуги по государственной регистрации медицинских изделий» возложена на Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор). Государственной регистрации подлежат ИМ как отечественного, так и зарубежного производства.
Порядок проведения основных исследований необходимых для регистрации ИМ определен в статье 38 часть 323-ФЗ:
«В целях государственной регистрации медицинских изделий в порядке , установленном уполномоченным федеральным органом исполнительной власти, проводятся оценка соответствия в форме технических испытаний, токсикологических исследований, клинических испытаний и экспертиза качества, эффективности и безопасности медицинских изделий, а также испытания в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается уполномоченным федеральным органом исполнительной власти)».
Проведение экспертизы качества, эффективности и безопасности осуществляется поэтапно:
1) первый этап — экспертиза заявления и документов, представленных с целью регистрации, для определения возможности (невозможности) проведения клинических испытаний медицинского изделия;
По результатам экспертизы этапа 1 Росздравнадзор выдает Разрешение на проведение клинического исследования.
2) второй этап — экспертиза полноты и качества результатов проведенных технических и токсикологических испытаний, клинических исследований, а также испытаний в целях утверждения типа средств измерений.
По результатам экспертизы этапа 2, в случае положительного заключения Росздравнадзор принимает решение о государственной регистрации и выдается Регистрационное удостоверение
Технические испытания медицинских изделий проводятся в форме испытаний и (или) оценки и анализа данных (далее соответственно — испытания, оценка и анализ данных) для проверки качества и безопасности медицинского изделия при использовании его в соответствии с назначением, предусмотренным документацией производителя.
Технические испытания в форме оценки и анализа данных проводятся только в отношении медицинских изделий, для монтажа (ввода в эксплуатацию) которых требуется получение разрешений (лицензий), создание специальных условий, строительство отдельных капитальных сооружений и дополнительного обучения специалистов, а в некоторых случаях — выезд на место производства медицинского изделия).
Технические испытания медицинских изделий для диагностики in vitro (приборы, оборудование, наборы реагентов, реагенты, реактивы, тест-системы, контрольные материалы, калибраторы, питательные среды) проводятся в целях проверки качества и безопасности медицинского изделия для диагностики in vitro при использовании его в соответствии с назначением, предусмотренным документацией производителя.
Технические испытания медицинских изделий для диагностики in vitro в виде закрытых аналитических систем, проводимые в отношении медицинского изделия вместе с принадлежностями, наборами реагентов и калибраторов, необходимыми для применения медицинского изделия по назначению, могут проводиться в рамках одного технического испытания.
Технические испытания медицинских изделий для диагностики in vitro основываются на:
а) анализе данных научно-технической литературы, относящейся к безопасности, эффективности, функциональности, а также к предусмотренному нормативной документацией, технической и эксплуатационной документацией производителя применению медицинского изделия для диагностики in vitro;
б) анализе результатов проведенных испытаний медицинского изделия для диагностики in vitro.
2. Токсикологические исследования
Токсикологические исследования медицинского изделия проводятся в отношении изделия, контактирующего с организмом человека при использовании его в соответствии с назначением, предусмотренным документацией производителя:
а) медицинское изделие и (или) принадлежности к медицинскому изделию, контактирующие с поверхностью тела человека;
б) медицинское изделие, временно вводимое в организм человека извне;
в) медицинское изделие, имплантируемое в организм человека.
Токсикологические исследования медицинского изделия проводятся для оценки биологического действия медицинского изделия на организм человека и включают в себя проверку следующих показателей:
в) биологических в условиях in vitro и in vivo.
3. Клинические исследования
Клинические испытания медицинских изделий проводятся в форме исследований (далее — анализ и оценка клинических данных) и в форме испытаний, в том числе с участием человека (далее — испытания с участием человека), осуществляемые для оценки безопасности и эффективности медицинского изделия.
Испытания медицинских изделий с участием человека проводятся в следующих случаях:
а) новый вид медицинского изделия;
| Видео (кликните для воспроизведения). |
б) применение новых сложных и (или) уникальных и (или) специальных методов профилактики, диагностики и лечения заболеваний и состояний, а также применение новых сложных медицинских технологий;
в) если при проведении анализа и оценки клинических данных не подтверждены эффективность и безопасность медицинского изделия.
В остальных случаях клинические испытания медицинских изделий проводятся в форме анализа и оценки клинических данных.
Клинические испытания медицинских изделий для диагностики in vitro проводятся в лабораторных условиях с применением образцов биоматериала пациентов, взятых в ходе лечебно-диагностического процесса (далее — клинико-лабораторные испытания) для проверки функциональных свойств и (или) эффективности медицинского изделия при использовании его в соответствии с назначением, предусмотренным документацией производителя.
Клинико-лабораторные испытания медицинских изделий для диагностики in vitro новых инфекционных заболеваний или редко встречающихся природно-очаговых инфекционных заболеваний проводятся в лабораторных условиях с применением музейных тест-штаммов из государственных, национальных, исследовательских и иных коллекций патогенных микроорганизмов.
Клинико-лабораторные испытания медицинских изделий для диагностики in vitro в виде аналитических систем, проводимые в отношении медицинского изделия вместе с принадлежностями, наборами реагентов и калибраторов, необходимыми для применения медицинского изделия по назначению, могут проводиться в рамках одного испытания.
Государственная регистрация МИ осуществляется на основании результатов технических и токсикологических испытаний, клинических исследований. Процесс регистрации ИМ начинается с подготовки регистрационного досье, которое представляет собой комплект документов, представляемых для государственной регистрации.
Наша компания осуществляет полный комплекс услуг для регистрации ИМ, начиная со стадии формирования регистрационного досье до стадии получения Регистрационного удостоверения.
Регистрационное удостоверение выдается в случае положительного заключения по результатам экспертизы на неограниченный срок и действительно при сохранении в неизменности всех изложенных в нем сведений об ИМ.
Залогом успеха является грамотный и ответственный подход как к разработке необходимых документов, так и подбору испытательных центров.
Наша компания стремиться максимально облегчить и ускорить процедуру регистрации для своих клиентов.
- Разработать программу исследований, подготовить: нормативный документ (НД), техническую документацию (ТУ, технический регламент), эксплуатационную документацию (руководство по эксплуатации, инструкция по эксплуатации, инструкция по применению), этикетку;
- Организовать и осуществить мониторинг технических и токсикологических испытаний, а также спланировать и провести клинические исследования ИМ, включая получение разрешения на клинические исследования в уполномоченных органах;
- Подготовить пакет документов для регистрации согласно действующим требованиям, оформить заявление на регистрацию;
- Предоставить документы в Росздравнадзор;
- Провести мониторинг экспертизы качества, эффективности и безопасности ИМ;
- Сопровождать прохождение документации в Росздравнадзоре с целью получения Регистрационного удостоверения на ИМ и получить Регистрационное удостоверение.
Нормативные ссылки:
Регистрация медицинских изделий
Законодательство Российской Федерации гласит, что медицинские изделия могут продаваться и применяться только после их регистрации. Функцию по контролю и надзору в сфере здравоохранения, социального развития осуществляет — Росздравнадзор. Также федеральная служба вносит в Реестр (регистрирует) медицинские изделия, разрешенные для медицинского применения во всех субъектах Российской Федерации.
Для успешной регистрации изделий медицинского назначения необходимы основания результатов соответствующих испытаний и оценок, подтверждающих качество, эффективность и безопасность медицинских изделий.
Сертификация медицинских изделий
Необходимо отметить, что Регистрация медицинской техники и изделий медицинского назначения оформляется на имя юридического лица или индивидуального предпринимателя, указываемого в заявлении о регистрации, выступающего на основании доверенности, оформленной производителем по утвержденной форме.
Аккредитованный Орган по сертификации и экспертная организация «СертПромЭкспертиза» окажет весь спектр услуг по регистрации медицинского оборудования и изделий: начиная с Заявления на регистрацию медицинского изделия и до получения Регистрационного удостоверения в Ваши руки.
Какие изделия медицинского назначения подлежат регистрации?
Приборы, оборудование, аппараты, инструменты, материалы и прочие изделия, которые применяются в медицинских целях как отдельно, так и в сочетании между собой или вместе с другими принадлежностями. Необходимыми для применения указанных изделий по назначению, предназначенные производителем для целей:
- диагностики заболеваний;
- профилактики заболеваний;
- лечения и медицинской реабилитации заболеваний;
- мониторинга состояния организма человека;
- проведения медицинских исследований;
- восстановления, замещения, изменения анатомической структуры или физиологических функций организма;
- предотвращения или прерывания беременности
И функциональное назначение их не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека.
Важно! К понятию «медицинское изделие» относиться и специальное программное обеспечение, используемое в медицинских целях
Подлежит ли лицензированию реализация медицинских изделий?
Согласно ст. 12 Федерального закона от 04.05.2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» реализация медицинских изделий не входит в перечень видов деятельности, на которые требуются лицензии.
Этапы Регистрации Медицинских изделий
- прием, оценка представленной заказчиком документации на регистрацию;
- в случае контакта изделия с телом пациента — необходимость проведения токсикологической оценки;
- проведение и организация технических испытаний медицинских изделий;
- в случае необходимости – выполнение испытаний на электромагнитную совместимость;
- в некоторых случаях, необходимо проведение испытаний для утверждения типа средств измерений медицинского назначения;
- проведение экспертизы актов о проведенных оценок и испытаний (1-й этап);
- получение направления и проведение клинических испытаний медицинских изделий;
- проведение экспертизы актов проведенных оценок и испытаний (2-й этап);
- регистрацию и внесение медицинских изделий в Единый государственный реестр МИ;
- оформление и выдачу медицинского регистрационного удостоверения Росздравнадзора.
Схема проведения государственной регистрации медицинских изделий
Классификация в зависимости от степени потенциального риска
Классификация по данному признаку осуществляется в соответствии с ГОСТ Р 51609-2000 «Изделия медицинские. Классификация в зависимости от потенциального риска применения». Указанная норма также приведена в Административном регламенте Росздравнадзора по исполнению государственной функции по регистрации изделий медицинского назначения.
- класс 1 – изделия с низкой степенью индивидуального риска и низкой степенью риска для общественного здоровья и окружающей среды;
- класс 2 – изделия с умеренной степенью индивидуального риска и (или) низкой степенью риска для общественного здоровья и окружающей среды; Класс 2 подразделяется на 2а и 2б — средней и повышенной степенью риска соответственно.
- класс 3 – изделия с высокой степенью индивидуального риска и (или) умеренной степенью риска для общественного здоровья и окружающей среды;
- класс 4 – изделия с высокой степенью индивидуального риска и высокой степенью риска для общественного здоровья и окружающей среды.
Цели регистрации медицинских изделий

Перечень необходимой документации для регистрации медицинских изделий:
- Опись документов (2 экз. в печатном виде + в эл. виде)
- Заявление о регистрации (2 экз. в печатном виде + эл.виде)
- Справка об изделии (краткая информация) (эл. виде)
- Копия свидетельства о внесении записи в Единый гос. Реестр юридических лиц, заверенная нотариально
- Копия свидетельства о государственной регистрации юридического лица, заверенная нотариально
- Копия свидетельства о постановке на учет в налоговом органе, заверенная нотариально
- Выписка из Единого государственного реестра юридического лица
Результатом работы с нашей компанией будет успешно проведенная сертификация медицинской техники, товаров и оборудования, а также получение необходимых разрешительных документов с возможностью продавать свой товар на территории Российской Федерации, а также республики Казахстан.
Экспертный центр «РегистрПро»
Экспертный центр « РегистрПро » оказывает широкий спектр услуг в области регистрации, сертификации и лицензирования в медицинской области. Мы представлены на рынке консалтинговых услуг в сфере производства и оборота медицинской техники и изделий медицинского назначения с 2005 года.
На протяжении этого периода Экспертный центр приобрел статус высокопрофессиональной компании, которая эффективно решает различные проблемы, возникающие в процессе допуска медицинских изделий на российский рынок.
В ходе работы мы осуществляем подготовку комплекта документов, формирующих регистрационное досье необходимое для Федеральной службы по надзору в сфере здравоохранения и социального развития, проводим консультирование клиентов в процессе экспертизы.
Специалистами Экспертного центра «РегистрПро» оказывается экспертно-консультационное содействие и рекомендации по подготовке и формированию необходимых документов в соответствии с требованиями действующего законодательства для дальнейшего получения разрешений Федеральной службы по экологическому, технологическому и атомному надзору. На основании выданных доверенностей осуществляется представление документов заказчика в Ростехнадзор и получение разрешений.

Экспертный центр «РегистрПро» имеет многолетний опыт добровольной и обязательной сертификации по стандартам ГОСТ Р и сертификации на соответствие Техническим Регламентам.
Если Вы столкнулись с необходимостью получить сертификаты на Ваше оборудование или продукцию, наши специалисты смогут эффективно и профессионально решить Вашу задачу!
Государственная регистрация медицинских изделий отечественного и зарубежного производства в ФС Росздравнадзор
О регистрации медицинской техники и медицинского оборудования
Процедура государственной регистрации в Федеральной Службе Росздравнадзора довольно непростое дело, требующее профессиональных знаний и навыков в сфере законодательства и нормативно-правовых актов, отвечающих за безопасность в области медицины.
О нашей компании по регистрации ИМН
О процедуре регистрации медизделий, медтехники и изделий медицинского назначения
Регистрация медтехники – непростой и достаточно трудоемкий в исполнении процесс. Масса различных форм документов, необходимых для регистрации изделий мед назначения, может привести вас в замешательство. Но наши специалисты, имея большой опыт работы и прочные знания, с легкостью оформят все необходимые документы по регистрации медоборудования. Вам не стоит волноваться и беспокоиться, как пройдет процедура регистрации мед. изделий. Все будет исполнено в срок и без задержек. По окончании процедуры регистрации ИМН, вам будет выдано регистрационное удостоверение Минздрава, а ваша компания сможет войти в перечень аккредитованных организаций, имеющих право без лишних препятствий реализовывать медицинскую деятельность на всей территории России, что немаловажно для благополучной и высококачественной работы вашего учреждения.
Смеем надеяться, что, однажды воспользовавшись нашей помощью в регистрации мед изделий, вы захотите снова обратиться к нам. Мы будем рады помочь вам в этом непростом, но нужном и благородном деле.
Регистрация медицинских изделий отечественного и зарубежного производства
Как известно, регистрация медицинских изделий является необходимым условием для их ввоза, использования, продажи, а также производства на территории России. Наша компания готова оказать услуги по регистрации и сертификации различных мед. изделий, а также медицинской техники. Благодаря решению этого щепетильного вопроса вам не придется беспокоиться за разрешение на продажу медицинских услуг и товаров.
Государственная регистрация в ФС Росздравнадзор – достаточно сложная и трудоемкая процедура, требующая определенных знаний законодательства и различных нормативно-правовых актов, которые отвечают за безопасность и качество в сфере медицины.
Солидный опыт наших специалистов в данной сфере позволит вам оперативно и без больших финансовых затрат зарегистрировать медицинскую технику российского и зарубежного производства и получить, наконец, удостоверение Росздравнадзора.
Все формы документов для предоставления их в Росздравнадзор имеют установленные стандарты и очень удобно и понятно заполняются. Регистрация медицинского оборудования – это процесс, который находится в компетенции наших сотрудников, поэтому не стоит и волноваться из-за того, как правильно и без ошибок заполнить все документы.
Регистрация медицинской техники позволит вашей компании войти в перечень аккредитованных организаций, которые могут беспрепятственно осуществлять медицинскую деятельность на территории Российской Федерации. Это очень важно для комфортной и успешной работы вашей организации.
Регистрация медицинских изделий
Регистрация медицинских изделий – государственная процедура, цель которой разрешить выпуск на российский рынок качественных и безопасных изделий.
Государственной регистрации подлежат любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем (изготовителем) для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека (далее — медицинские изделия).
Медицинские изделия, изготовленные по индивидуальным заказам пациентов, к которым предъявляются специальные требования по назначению медицинских работников и которые предназначены исключительно для личного использования конкретным пациентом, государственной регистрации не подлежат.
Государственная регистрация медицинских изделий осуществляется Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор).
Государственная регистрация медицинских изделий проводится на основании результатов технических испытаний, токсикологических исследований, клинических испытаний, представляющих собой формы оценки соответствия медицинских изделий с учетом классификации в зависимости от потенциального риска их применения, и экспертизы качества, эффективности и безопасности медицинских изделий с учетом классификации в зависимости от потенциального риска их применения, а также испытаний в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается Министерством здравоохранения Российской Федерации).
Документом, подтверждающим факт государственной регистрации медицинского изделия, является регистрационное удостоверение на медицинское изделие. Форма регистрационного удостоверения утверждается регистрирующим органом.
Частью 4 статьи 38 Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» установлено, что на территории Российской Федерации разрешается обращение медицинских изделий, зарегистрированных в порядке, установленном Правительством Российской Федерации, уполномоченным им федеральным органом исполнительной власти.
Федеральный закон от 31.12.2014 № 532-ФЗ предусматривает административную и уголовную ответственность за незаконное производство медицинских изделий, обращение фальсифицированных, недоброкачественных, контрафактных и незарегистрированных медицинских изделий, подделку документов на медицинские изделия или их упаковки.
С особенностями регистрации изделий иностранного производства Вы можете ознакомиться на странице нашего сайта
Схему регистрации изделий отечественного производства найдете по ссылке
Причины внесения изменений в документы, содержащиеся в регистрационном досье отражены на странице
Регистрация по правилам ЕАЭС здесь
Найдите ответ на интересующий Вас вопрос в разделе Вопросы и ответы или задайте вопрос про регистрацию медизделий нашему специалисту online.
Выберите удобный для себя офис в Москве или Санкт-Петербурге для консультаций с нашими специалистами
Сертификация изделий медицинского назначения и медицинской техники
Наша компания предлагает услуги по регистрации изделий медицинского назначения и изделий медицинской техники.
Регистрация изделий медицинского назначения и медицинской техники (ИМН) регулируется Административным регламентом Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по регистрации изделий медицинского назначения, утвержденным Приказом Министерства здравоохранения и социального развития Российской Федерации от 30 октября 2006г. № 735.
Согласно данному Административному регламенту, регистрация ИМН проводится Федеральной службой по надзору в сфере здравоохранения и социального развития и осуществляется на имя юридического лица или индивидуального предпринимателя, указываемого в заявлении о регистрации. Регистрация ИМН проводится с целью допуска ИМН к производству, импорту, продаже и применению на территории Российской Федерации. Документом подтверждающим факт регистрации ИМН является Регистрационное удостоверение.
Регистрации подлежат все изделия медицинского назначения, предполагаемые к медицинскому применению на территории Российской Федерации и включающие в себя приборы, аппараты, инструменты, устройства, комплекты, комплексы, системы с программными средствами, оборудование, приспособления, перевязочные и шовные средства, стоматологические материалы, наборы реагентов, контрольные материалы и стандартные образцы, калибраторы, расходные материалы для анализаторов, изделия из полимерных, резиновых и иных материалов, программное обеспечение, которые применяют в медицинских целях по отдельности или в сочетании между собой и которые предназначены для:
- профилактики, диагностики (in vitro), лечения заболеваний, реабилитации, проведения медицинских процедур, исследований медицинского характера, замены и модификации частей тканей, органов человека, восстановления и компенсации нарушений или утраченных физиологических функций, контроля над зачатием;
- воздействия на организм человека таким образом, что их функциональное назначение не реализуется путем химического, фармакологического, иммунологического или метаболического воздействия с организмом человека, однако, способ действия которых может поддерживаться таким средствами.
В случае регистрации ИМН, воспроизводящего зарегистрированный на территории Российской Федерации аналог, процесс регистрации осуществляется в течение 2-х месяцев со дня подачи комплекта документов. При отсутствии зарегистрированных аналогов ИМН, принятие решения о регистрации ИМН осуществляется в срок до 4-х месяцев со дня подачи комплекта документов.
Регистрация ИМН осуществляется на основании результатов соответствующих испытаний и оценок, подтверждающих качество, эффективность и безопасность изделий. Заявителю необходимо предоставить результаты технических и токсикологических испытаний ИМН, а в случае решения о необходимости проведения клинических испытаний — результаты клинических испытаний (решение о необходимости проведения клинических испытаний принимается экспертной комиссией в течение 65 дней со дня регистрации в Росздравнадзоре комплекта документов). При необходимости в проведении клинических испытаний ИМН, срок процедуры государственной регистрации приостанавливается на срок необходимый заявителю для проведения данных испытаний.
Сертификация программ медицинского назначения
При изготовлении программ, предназначенных для использования в области медицины, производитель должен позаботиться о сертификации продукта, обратившись в специализированный сертификационный центр. Важно учесть, что правом сертификации и проведение сертификационных мероприятий (в том числе необходимых испытаний) данных продуктов обладает только аккредитованный орган – и, если орган сертификации не имеет соответствующих разрешений его деятельность считается незаконной.
Цель сертификации медицинских программ (ПО медицинского назначения)
Согласно приказу Министерства здравоохранения, сертификация и испытания программных средств медицинского назначения производятся с целью:
- Подтверждения качества программной продукции, которые были заявлены изготовителем, путем проведения необходимых испытаний (перечень испытаний определяется в индивидуальном порядке).
- Контроля безопасности программной продукции.
- Защиты потребителей от недобросовестных изготовителей – основная цель которых не изготовить качественный продукт, а получить как можно больше прибыли, приложив минимальное количество усилий.
В ходе проведения сертификационных действий в отношении программного продукта, он подвергается различным видам испытаний. Если в ходе сертификации и проведения испытаний продукции будет выявлено несоответствие требованиям безопасности, то подтверждающий качество документ не будет выдан. Если же в ходе испытаний качестве продукции будет подтверждено, то заявитель получит сертификат соответствия с учетом всех требований Министерства здравоохранения.
Выдача сертификата
После того, как программа медицинского назначения прошла все необходимые при сертификации проверки (в том числе испытания) и ее качество было подтверждено по результатам испытаний, компании-заявителю выдается сертификат соответствия установленного образца. В сертификате программного продукта указываются следующие сведения:
- Наименование документа (сертификат программного продукта);
- Номер;
- Дата выдачи;
- Данные компании-разработчика, которой потребовалось проведение сертификационных испытаний программы медицинского назначения, а также адрес и сведения о лицах, выступающих в качества авторов;
- Наименование программного продукта медицинского назначения;
- Перечень документов, на основании которых был выдан сертификат;
- Срок действия сертификата;
- Краткое описание программного обеспечения – объекта сертификационных испытаний (наименование, назначение, функции, сфера применения, тип, используемые операционные системы и языки программирования, сетевое обеспечение, данные о внутренней и внешней памяти, наличие аналогов и ограничений).
Помимо вышеуказанных программ, подлежат сертификации и сами изделия, предназначенные для применения в области здравоохранения. О том, каким образом это происходит, пойдет речь ниже.
Регистрация мед. изделий
Законодательство, действующее на территории России, гласит, что медицинские изделия могут реализовываться и использоваться только после регистрационных действий. Функцию по надзору в сфере здравоохранения осуществляет Росздравнадзор, его уполномоченные сотрудники и контролируют наличие документов на продукт. Также сотрудники данного органа вносят в Реестр медизделия, которые были разрешены для медицинского применения во всех регисонах России.
Для успешной регистрации изделия мед. назначения требуется наличие результатов соответствующих испытаний и оценок, которые могли бы подтвердить безопасность и в целом качество продукта.
Сертификация медизделий
Регистрация медицинской техники и мед. изделия, оформляется на имя организации или ИП, которые обращаются за совершением сертификационных действий.
Наш орган по сертификации, имеющий аккредитацию и все необходимые разрешения, предоставит весь перечень услуг по регистрационным действиям мед. оборудования и изделия. Для обращения к нам, вам требуется оформить заявку, представленную заявку или же заполнить заявление на регистрацию медизделия установленного образца. В заявку, как правило, требуется внести следующие сведения:
- Наименование организации, выступающей в качестве заявителя (или Ф.И.О индивидуального предпринимателя);
- Сведения о продукте;
- Контактные данные заявителя;
- Дополнительные сведения.
После поступления заявления, оно поступает в обработку специалистам компании, после чего они связываются с заявителем, уточняют необходимые детали и предоставляют перечень документов, которые требуется предоставить. После предоставления документов, меду сторонами заключается договор на предоставление услуг по сертификации, а затем специалисты приступают к совершению необходимых мероприятий.
Какие изделия медназначения подлежат сертификации?
Приборы инструменты, а также иные товары, которые применяются в мед. целях подлежат сертификации – в противном случае, их невозможно будет реализовать ни в одно специализированное учреждение. Если говорить о конкретном оборудовании, то на территории Российской Федерации подлежат сертификации следующие виды товаров:
- диагностики и профилактики различных заболеваний;
- лечения и реабилитации пациентов;
- мониторинга организма пациентов;
- проведения различных медицинских исследований и испытаний;
- предотвращения либо прерывания беременности.
Важно учесть, что к понятию «медицинское изделие» относиться и специальное ПО, используемое в мед. целях
Подлежит ли сертификации реализация медизделий?
Согласно ст. 12 ФЗ №99 «О лицензировании отдельных видов деятельности» и иных НТД реализация медизделий не входит в перечень видов деятельности, на которые требуются осуществлять получение лицензии – поэтому компании, осуществляющие реализацию не обязаны лицензировать свою деятельность – в отличие от производителей.
Этапы регистрации и сертификации медизделий и программных компонентов
Регистрационные действия в отношении медизделий, совершаются в следующем порядке:
- прием и рассмотрение представленной документации заказчиком специалистами уполномоченной организации;
- в случае, если использование продукта подразумевает его контакт с телом пациентов, то следующий этап выявление необходимости проведения токсикологической оценки;
- организация проведения тех. испытаний медизделий;
- выполнение испытаний на совместимость (если будет выявлена такая необходимость);
- проведение клинических испытаний;
- проведение испытаний, которые требуются для утверждения типа средств измерений;
- организация проведения экспертизы актов испытаний;
- внесение объектов проверки (мед. изделий) в Единый реестр МИ;
- оформление и выдача заказчику работ регистрационного удостоверения уполномоченного органа — Росздравнадзора установленного образца.
План проведения регистрации медизделий разрабатывается специалистами в индивидуальном порядке.
Классификация товара в зависимости от степени риска
Классификация по степени риска должна осуществляться в соответствии со стандартом ГОСТ Р 51609-2000. Эта норма также содержится в регламенте органа по выполнению государственной функции по регистрационным действиям изделий мед. назначения — здравоохранения.
Цели регистрационных действий изделий и программных средств
Если все этапы будут пройдены успешно, то для медицинских продуктов и ПО выдается соответствующее регистрационное удостоверение установленного образца, срок действия которого не ограничен. В случае получения разрешительных документов продукцию возможно будет реализовать и использовать не только в России, но и на территории других стран с аналогичными требованиями.
Какие документы нужны?
В перечень необходимой документации для испытаний программного средства и подтверждения соответствия, входит:
- Опись приложение (обычно требуется предоставить по 2 экземпляра в печатном и электронном виде);
- Заявление установленного образца (как правило, также подается в печатном и электронном виде);
- Справка об изделии, содержащая краткую информацию;
- Копия свидетельства о государственной регистрации компании, которая была заверена в нотариальной конторе;
- Устав компании (обычно требуется первые 3 и последние 3 страницы);
- Копия свидетельства, подтверждающая постановку заявителя на учет в межрайонной инспекции федеральной налоговой службы (МРИФНС);
- Выписка из ЕГРЮЛ (или ЕГРИП – если заявителем выступает индивидуальный предприниматель).
| Видео (кликните для воспроизведения). |
В некоторых случаях, для проведения сертификационных мероприятий и испытаний могут потребоваться приложение дополнительных – об этом специалисты известят заранее.
Результатом сертификации (сертификационных действий в отношении продукции), в том числе и ПС- программных средств, будет получение необходимых разрешительных документов, предоставляющих возможность использовать товар на территории России
(Российской Федерации), а также других стран. Именно поэтому, если вам потребовалась сертификация программ медицинского назначения или же других товаров в максимально короткие сроки, предлагаем воспользоваться нашими услугами. Для сертификации и проведения испытаний, предлагаем вам заполнить форму на нашем сайте, и мы в максимально короткие сроки организуем проведение всех необходимых сертификационных мероприятий.
Источники
Чиркин, В. Е. Основы сравнительного правоведения / В.Е. Чиркин. — М.: МОДЭК, НОУ ВПО Московский психолого-социальный университет, 2014. — 392 c.
Адвокатская деятельность и адвокатура в России. Часть 2. Особенная часть, специализация / ред. И.Л. Трунов. — М.: Эксмо, 2016. — 864 c.
Адвокатская деятельность и адвокатура в России / Под редакцией И.Л. Трунова. — М.: Юрайт, 2016. — 528 c.
-
Общая теория государства и права. Академический курс в 3 томах. Том 1. — Москва: Высшая школа, 2001. — 528 c.

Здравствуйте! Меня зовут Степан Рязанов. Я более 12 лет работаю в фирме по предоставлению юридических услуг. За это время я столкнулся с множеством разных задач в этой области. Поэтому я хочу помочь посетителям данного сайта узнать свои юридические права.
Информацию для сайта администраторы собирали со всех доступных источников. Тщательно обработанные данные были выложены в полном объеме и доступном виде для всех посетителей. Перед применением данных, прочитанных на данном сайте необходима обязательная консультация со специалистом.